PRP – concentrés plaquettaires
LA PLACE DES DERIVES PLAQUETTAIRES : Se faire traiter par son propre sang...pourquoi ?
PRP – concentrés plaquettaires
Historique des concentrés plaquettaires
Les concentrés plaquettaires PRP sont à l’origine des dérivés du sang utilisés en hématologie pour la prévention et le traitement des hémorragies dues à des thrombopénies graves d’origine centrale.
Les concentrés plaquettaires utilisés comme adjuvants chirurgicaux puis en traumatologie du sport ont été arbitrairement dénommés PRP comme les concentrés plaquettaires standards de l’hématologie transfusionnelle.
Selon les fabricants de matériel et les auteurs, différents termes sont employés pour définir ces concentrés plaquettaires : PRP (Platelet Rich Plasma ou Plasma Riche en Plaquettes), cPRP (concentrated PRP), PRGF (Plasma Rich in Growth factors, plasma riche en facteurs de croissance), sang autologue. Nous verrons que ces concentrés sont variables dans leur composition, en terme de concentration en facteurs de croissance, en fibrinogène, en plaquettes, voir par la présence de leucocytes ou de granulocytes, ou encore de l’utilisation d’un activateur. (Anitua E, Sanchez M et al : Shedding light in the controversial terminology for platelet rich plasmas. J Biomed Mat Res A 2008)
Les premières utilisations de concentrés plaquettaires autologues, le PRF (Platelet Rich Fibrin, sang total sans anticoagulant) remontent aux années 1970 dans les indications de chirurgie maxillo-faciale par Matras H. (2). L’utilisation de ce procédé s’est largement développée dans les années 90 en Amérique du Nord, en Asie et en Europe, comme adjuvant chirurgical (3,4,5), pour prendre une place importante en traumatologie du sport depuis une dizaine d’années.
Les indications sont nombreuses, d’abord comme adjuvant chirurgical dans les réparations tendineuses, osseuses et ligamentaires, puis médicales dans les tendinopathies, les lésions ligamentaires ou musculaires et les chondropathies traumatiques ou dégénératives.
Le comité exécutif de l’A.M.A. (Agence Mondiale Antidopage) réuni le 18 septembre 2010 à Montréal a retiré de la liste 2011 des substances et méthodes interdites l’usage des préparations dérivées des plaquettes (PRP).
Principe de base scientifique - mécanisme d’action
Les mécanismes naturels de la cicatrisation sur un organisme en cas de lésion vasculaire sont les suivants : activation puis agrégation plaquettaire, stabilisation de la fibrine permettant la formation d’un thrombus (caillot) et libération de facteurs de croissance, stimulant la prolifération cellulaire et ainsi la cicatrisation.
Le principe du traitement par PRP est de reproduire ces mécanismes de cicatrisation et de régénération tissulaire par injection dans le tissu lésé de plasma sanguin autologue concentré en plaquettes. Ce tissu peut être un tendon, un ligament, un muscle, un os ou une articulation. L’utilisation est purement médicale ou accompagne un geste chirurgical.
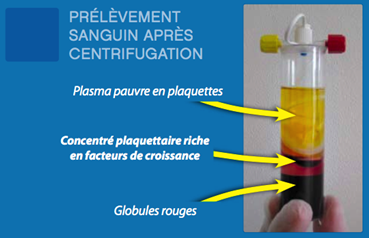
La préparation de PRP nécessite un prélèvement sanguin, qui est centrifugé pour séparer le plasma pauvre en plaquette (PPP,5%) en surface, le plasma riche en plaquette et en fibrinogène (PRP, 40%) au milieu, des granulocytes et des leucocytes au fond du tube (55%). Le séparateur cellulaire permet d’augmenter la concentration en plaquettes et en facteurs de croissance contenus dans leurs alpha- granules de 200 à 600%. Selon le matériel utilisé et la simple ou double centrifugation, la composition du PRP peut être variable en termes de concentration de plaquettes et de facteurs de croissance ; il ne doit contenir ni granulocytes, ni leucocytes et ne doit pas être coagulé.
L’utilisation d’un anesthésique local avant l’injection du PRP n’est pas recommandée par la majorité des auteurs, il modifierait le pH local, hors le PRP est très ph-dépendant.
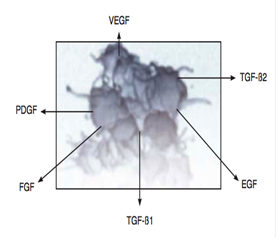
Le plasma concentré en plaquettes est ensuite réinjecté dans la zone pathologique. Ces plaquettes libèrent des facteurs de croissance en grand nombre, permettant la cicatrisation des tissus lésés en stimulant les cellules souches locales, et réduisent inflammation et hémorragie. L’hypothèse physiopathologique est que ce sont le TGF β (transforming growth factor β) et le bFGF ( basic fibroblast growth factor) qui agissent comme des médiateurs humoraux pour déclencher la cascade de la cicatrisation (1). D’autres facteurs interviennent dans la prolifération, la différenciation et la migration cellulaires ou encore dans l’angiogénèse, comme le PDGF (platelet-derived growth factor), le ECGF (endothelial cell growth factor), le PD-EGF (platelet-derived epithelial growth factor), les IGF–I, II (insuline-like growth factor), le VEGF (vascular endothelial growth factor) et le ECGF (endothelial cell growth factor). Les granules alpha des plaquettes contiennent également des molécules bios actives comme la sérotonine, l’histamine, la dopamine, les adénosines, le calcium, les catécholamines, qui jouent un rôle biologique fondamental dans les trois les phases de la réparation (inflammation, prolifération, remodelage). De ces propriétés ont découlé un grand nombre d’indications thérapeutiques qu’il convient de mieux évaluer.
Les concentrés plaquettaires auraient des propriétés bactériostatiques, mises en évidence sur le Staphylocoque epidermidis et le Staphylocoque aureus, réduisant ainsi les risques de contamination microbiale de la zone traitée (Endoret de Biotechnology Institute).
Les AINS ne doivent pas être utilisés les jours précédents et les deux semaines qui suivent l’injection de PRP, ils risquent d’inhiber l’action des prostaglandines et ainsi les effets stimulateurs du PRP. On évitera également les soins locaux anti-inflammatoires y compris l’application de poche de froid. En cas de douleur, on aura recours au paracétamol.
Les principales études en traumatologie du sport
C’est en chirurgie maxillo-faciale que la bibliographie est la plus riche sur l’effet cicatrisant du PRP, avec une première publication de H. Matras (2) en 1985 et depuis de nombreuses publications de Marx RE (5) et J. Choukroun en France (15).
Les études sont nombreuses en traumatologie du sport, cherchant à démontrer l’efficacité des injections de PRP dans les lésions musculaires (7), les tendinopathies chroniques (6, 10, 13, 16, 17, 18) et dans de nombreuses indications chirurgicales (9, 11).
La tendinopathie épicondylienne a fait l’objet de plusieurs études, j’ai retenu celles d’Al Mishra et Pavelko (13) et d’Edwards SG et Calandruccio (6). Les patients traités par PRP sont des échecs au traitement médical bien conduit, incluant la kinésithérapie, les infiltrations et la contention. Le diagnostic est confirmé par une IRM ou une échographie. Le traitement par PRP est toujours suivi du protocole habituel de renforcement musculaire excentrique et retour progressif aux activités en 6 à 8 semaines. L’étude de Mishra et Pavelko en 2006 inclut 20 patients, 15 traités par PRP et 5 pour le groupe contrôle traités par la seule injection d’un anesthésique local. Dans le groupe traité, il note 60% d’amélioration à 8 semaines, 81% à 6 mois, 93% en fin de suivi (12-38 mois). 3 patients du groupe contrôle sont sortis de l’étude ne permettant pas de faire une étude comparative. Edwards et Calandruccio en 2003 rapportent 79% de bons résultats sur une étude incluant 22 patients traités par du sang total non centrifugé, sans groupe contrôle. De nombreuses études valident l’utilisation des PRP dans les tendinopathies calcifiantes.
La tendinopathie achilléenne est souvent retrouvée en pathologie sportive, avec un échec fréquent des traitements conservateurs, 25 et 45% selon les études, offrant au PRP une prometteuse alternative au traitement chirurgical. Elle regroupe plusieurs entités, la tendinopathie corporéale, l’entésopathie et la péritendinite, parfois associées. La tendinopathie corporéale est générée par des micotraumatismes répétés sur une zone hypovascularisée, conduisant parfois à la rupture. L’hypothèse est que le PRP pourrait permettre la revascularisation et améliorer la cicatrisation tendineuse. Une seule étude de R.J. de Vos (10) a retenu mon attention, randomisée, en double-aveugle, avec un groupe traité (27 patients) et un groupe contrôle (27 patients traités par solution saline), avec des résultats équivalents dans le groupe traité et le groupe témoin. Deux reproches peuvent être fait sur le protocole thérapeutique, l’utilisation d’un anesthésique local qui perturberait l’efficacité du PRP et un traitement unique par PRP alors que les recommandations, issues des analyses histologiques, recommandent 3 injections à une semaine d’intervalle. Miquel Sanchez a publié une petite série en 2007 (9), utilisant le PRP comme adjuvant chirurgical dans la rupture du tendon d’Achille.
La fasciite plantaire a fait l’objet d’une publication par Barret et Erredge en 2004 (14) sur une petite série de 9 patients résistants au traitement médical habituel, injectés sous contrôle échographique, obtenant 77,9% de guérison à 1 an, sans groupe contrôle. Le traitement médical n’incluait pas le traitement par ondes de choc extracorporelles qui donnent d‘excellents résultats et doit être un préalable au PRP. R.J. Devos (10) a retenu 3 études (16, 17, 18) pour leur méthodologie de qualité, avec des résultats mitigés.
La tendinopathie patellaire chronique ou jumper’s knee est une pathologie sportive parfois invalidante pour les athlètes. Moins invasif et avec des suites courtes, le PRP peut présenter une alternative intéressante à la chirurgie dans ces tendinopathies rebelles, résistantes au traitement médical bien conduit incluant physiothérapie, massage transversal profond, AINS et travail dynamique excentrique. On notera l excellent papier de Filardo G et al en 2010
Graziani (20) a étudié l’action in vitro des concentrés plaquettaires sur les ostéoblastes et les fibroblastes. Il a mis en évidence le rôle stimulateur du PRP sur la prolifération cellulaire, particulièrement nette à 72 heures, maximum pour une concentration plaquettaire de 2,5x des concentrations plus élevées réduisent cette prolifération. Cette étude est un élément de réponse dans le choix de la concentration en plaquettes à utiliser dans les protocoles thérapeutiques.
Les publications dans l’arthrose
L’utilisation des concentrés plaquettaires dans l’arthrose et les chondropathies intéresse de nombreux auteurs, cherchant à préciser leur mode d’action et à comparer leur efficacité par rapport aux injections d’acide hyaluronique.
Graziani (20) dans l’étude in vitro résumée ci-dessus a confirmé le rôle stimulateur du PRP sur la prolifération cellulaire d’une culture d’ostéoblastes et de fibroblastes sains.
Gerben M. van Buul(22) a étudié l’effet des concentrés plaquettaires (6x) sur des cultures de chondrocytes humains issus de genoux arthrosiques. De nombreuses études ont montré les effets anabolisants du PRP sur le chondrocyte sain. Tout l’intérêt de cette étude est d’analyser l’effet du PRP sur le cartilage dégénératif. La mise en évidence d’une inhibition des processus inflammatoires encourage son utilisation dans l ‘arthrose
E. Anitua (23) a observé l’effet du PRGF (concentré plaquettaire 2 à 3x) sur des chondrocytes issus d’articulations arthrosiques. Il a mis en évidence un rôle stimulateur sur la sécrétion d’acide hyaluronique et l’angiogénése.
Sanchez et al (19) ont étudié, de manière prospective, l’efficacité de l‘injection intra articulaire de PRGF dans la gonarthrose sur30 patients, comparée à un groupe contrôle de 30 patients traités par l’injection intra articulaire d’acide hyaluronique, à raison de 3 injections à une semaine d’intervalle. Ils concluent à 33,4% de résultats positifs sur la douleur à 5 semaines dans le groupe PRGF et 10% dans le groupe acide hyaluronique.
Elizaveta Kon (21) a analysé l’efficacité d’un traitement par PRP versus acide hyaluronique dans le genou atteint d’arthrose ou de chondropathie dégénérative. L’analyse porte sur 3 groupes homogènes de 50 patients traités soit par un AH à bas poids moléculaire (AHBP), soit par un AH à haut poids moléculaire (AHHP), soit par le PRP. Le protocole retenu consistait en l’injection de 5 ml de concentré plaquettaire (6x, anticoagulé et activé), 3 fois à 14 jours d’intervalle. Les patients ont été évalués par le score IKDC avant traitement, à 2 mois et à 6 mois. Les résultats montrent une efficacité plus grande et plus prolongée du traitement par PRP chez les patients plus actifs et avec des lésions moins évoluées. Les résultats à 6 mois du traitement par PRP ou AH sont comparables chez les sujets plus âgés. Les auteurs ont fait le choix d’une concentration en plaquettes nettement plus élevée que dans l’étude in vitro de Graziani. La concentration idéale en plaquettes n’est peut-être pas la même selon les indications thérapeutiques et les sites d’injection.
Les publications dans l’assocociation à la chirugie
L’utilisation des concentrés plaquettaires en adjuvant à la chirurgie a été décrit par de nombreux auteurs (Charrousset, Randelli, Sanchez ) comme accélérateur de la cicatrisation. Notamment dans la ligamentoplastie du genou (Sanchez) , réinsertion des tendons de la coiffe des rotateurs( Randelli, Shaikh et 0’donnell), Suture du tendon d’Achille, Tendinopathie calcifiantes de la coiffe des rotateurs.
Les Fractures
L’utilisation des PRP comme aide à la consolidation des fractures a été décrite mais les publications sont très limitées sur cette indication qui reste à l’étude .
Investigating the effect of intra-articular PRP injection on pain and function improvement in patients with distal radius fracture
H. Namazi, A. Mehbudi in OTSR vol 102-1-feb 2016, 1-139
Conclusion :
L’utilisation du PRP remonte à près de 30 ans en chirurgie maxillo-faciale. Son utilisation s’est largement répandu en traumatologie du sport depuis une dizaine d’années, comme alternative à la chirurgie ou comme adjuvant chirurgical. De nombreuses études ont été réalisées, peu de qualité irréprochable (petites séries, pas de groupe contrôle). Des succès, très médiatisés, chez des sportifs de haut niveau puis la suppression de la liste des substances et méthodes interdites par l’AMA fin 2010 ont fait littéralement flamber l’attrait pour cette technique.
Les risques de complications liées à l’utilisation du PRP sont faibles, d’abord parce le produit, issu du propre sang du patient, n’a pas de risque de rejet ou d’allergie. Le seul risque inhérent à toute injection est infectieux, probablement inférieur à celui des infiltrations de corticoïde du fait des propriétés bactériostatiques du PRP et de l’utilisation d’un matériel en circuit fermé, du prélèvement à l’injection. Quant à l’effet tératogène de l’injection de facteurs de croissance autologues il est tout à fait théorique et jamais observé par les auteurs.
Les concentrés plaquettaires, nous l’avons vu, ne sont pas standardisés, tant sur la concentration en plaquettes et en facteurs de croissance, la présence ou non de leucocytes ou de granulocytes, que l’activation ou non par le chlorure de calcium. Les protocoles thérapeutiques sont variables, l’utilisation d’un anesthésique local, le nombre d’injections (1 à 3), le délai entre chaque injection et dans les lésions musculaires le délai par rapport aux lésions initiales sont mal définis. Le guidage par l’imagerie du geste est inconstant.
Selon l’étude de Graziani (20) l’effet sur la prolifération cellulaire serait maximum pour des concentrations plaquettaires à 2,5x, réduit pour des concentrations plus élevées, rejoignant en ce sens d’autres auteurs en particulier Weibrich (24).
Nous conseillons la lecture de l excellente mise à jour sur l’ utilisation des PRP dans le journal de l’Académie Americaine par : HSU,MISHRA, RODEO, FU, TERRY, RANDELLI, CANALE, KELLY : Platelet-rich plasma in orthopaedic Applications : Evidence-based recommendations for treatment J Am Acad Orthop Surg 2013 ; 21 : 739-748
Bibliographie
1. Iwasaki M, Nakahara H, Nakata K, Nakase T, Kimura T, Ono K. Regulation of proliferation and osteochondrogenic differentiation of periosteum-derived cells by transforming growth factor-beta and basic fibroblast growth factor. J Bone Joint Surg Am 1995; 77:543-554.
2. Matras H. Fibrin sealant in maxillofacial surgery. Development and indications. A review of the past 12 years. Facial Plast. Surg 1985;2:297-313.
3. Proliferation and osteochondrogenic differentiation of periosteum-derived cells by transforming growth factor-beta and basic fibroblast growth factor. J Bone Joint Surg Am 1995; 77:543-554.
4. Everts PA, Knape JT, Weibrich G, et al. Platelet-rich plasma and platelet gel: a review. J Extra Corpor Technol 2006; 38:174-187.
5. Marx R GA. Dental and craniofacial applications of plateletrich plasma, 2005.
6. Edwards SG, Calandruccio JH. Autologous blood injections for refractory lateral epicondylitis. J Hand Surg Am 2003; 28:272-278.
7. Sampson S, Gerhardt M, Mandelbaum B. Platelet rich plasma injection grafts for musculoskeletal injuries: a review. Curr Rev Musculoskelet Med 2008; 1:165-174.
8. Platelet-Rich Plasma . From basic science to clinical applications. The American Journal of Sports Medecine 2009, Vol.37, n°11.
9. Mikel Sanchez. Comparison of Surgically repaired Achilles tendon tears using Platelet-Rich Fibrin matrice. The American Journal of Sports Medecine, Vol 35, n°2
10. R.J. de Vos, P.L.J. van Veldhoven, M.H. Moen, A. Weir, J.L.Tol and N. Maffuli. Autologous growth factor injections in chronic tendinopathy : a systematic review. British Medical Bulletin Advance Access March 2, 2010.
11. Sánchez M, Anitua E, Orive G, Mujika I, Andia I. Platelet-rich therapies in the treatment of orthopaedic sport injuries. Sports Med. 2009;39(5):345-54.
12 Paola Bendinelli, Emanuela Matteucci, Giada Dogliotti, Massimiliano M. Corsi,
Giuseppe Banfi, Paola Maroni and Maria Alfonsina Desiderio. Molecular basis of anti-infammatory action of Platelet Rich Plasma on human chondrocytes : mechanisms of NF-kB inhibition via HGF. Journal of cellular Physiology 2010 Wiley-Liss, Inc.
13. Allan Mishra, MD* and Terri Pavelko, PAC, PT. Treatment of chronic elbow tendinosis with Buffered Platelet-Rich Plasma. American Orthopaedic Society for ports Medecine. 2006.
14. Barret S, Erredge S. Growth factors for chronic plantar fascitis. Podiatry Todday. 2004 ; 17 :37-42
15. Choukroun J, Adda F, Schoeffler C, Vervelle A. Une opportunité en paro-implantologie. Le PRF (platelet rich fibrin). Implantodont 2001;41:55-62.
16. Kiter E, Celikbas E, Akkaya S et al. (2006) Comparison of injection modalities in the treatment of plantar heel pain: a randomised controlled trial. J Am Podiatr Med Assoc, 96, 293-6.Kiter et al. 2006
17. Kalaci A, Cakici H, Hapa O et al. (2009) Treatment of plantar fasciitis using four different local injection modalities: a randomised prospective clinical trial. J Am Podiatr Med Assoc, 99, 108-13.
18. Lee TG, Ahmad TS (2007) Intralesional autologous blood injection compared to corticosteroid. injection for treatment of chronic plantar fasciitis. A prospective, randomised, controlled trial. Foot Ankle Int, 28, 984-90.
19. Sánchez M, Anitua E, Azofra J, Aguirre JJ, Andia I. Intra-articular injection of an autologous preparation rich in growth factors for the treatment of knee OA: a retrospective cohort study. Clin Exp Rheumatol. 2008 Sep-Oct;26(5):910-3.
20. Graziani F, Ivanovski S, Cei S, Ducci F, Tonetti M, Gabriele M. The in vitro effect of different PRP concentrations on osteoblasts and fibroblasts. Clin. Oral. Impl. Res. 17, 2006, 212-219.
21. Elizaveta Kon, M.D., Bert Mandelbaum, M.D., Roberto Buda, M.D., Giuseppe Filardo, M.D., Marco Delcogliano, M.D., Antonio Timoncini, M.D., Pier Maria Fornasari, M.D., Sandro Giannini, M.D., and Maurilio Marcacci, M.D.Platelet-Rich Plasma Intra-Articular Injection Versus Hyaluronic Acid Viscosupplementation as Treatments for Cartilage Pathology: From Early Degeneration to Osteoarthritis.
Arthroscopy: The Journal of Arthroscopic and Related Surgery, Vol 27, No 11 (November), 2011: pp 1490-1501
22. Gerben M. van Buul,*y MD, Wendy L.M. Koevoet,z BSc, Nicole Kops,* BSc, P. Koen Bos,* MD, PhD, Jan A.N. Verhaar,* MD, PhD, Harrie Weinans,* PhD, Monique R. Bernsen,y PhD, and Gerjo J.V.M. van Osch,*z§ PhD Investigation performed at Erasmus MC, Rotterdam, the Netherlands. Platelet-Rich Plasma Releasate Inhibits Inflammatory Processes in Osteoarthritic Chondrocytes. The American Journal of Sports Medicine, Vol. 39, No. 11.
23. E. Anitua, M. Sanchez, A.T. Nurden, M.M. Zalduendo, M. de la Fuente, J. Azofra and I. Andia. Platelet – released growt factors enhance the secretion of hyaluronic acid and induce hepatocyte growth factor production by synovial fibroblats from arthritic patients. Rheumatolgy 2007 ;46 :1769-1772. Advance Access publication 17 October 2007.
24. Weibrich y col. Effect of platelet concentration in platelet rich plasma on peri-implant bone régénération. Bone 2004 ;665-671.
25. Sanchez M, Anitua A : Comparison of surgically Repaired achileis tendon tear using PRP : Am j of sport Medicine, 2007, 85 245-251
26. Christophe Charousset, Amine Zaoui, Laurence Bellaiche and Benjamin Bouyer : Are Multiple Platelet-Rich Plasma Injections Useful for Treatment of Chronic Patellar Tendinopathy in Athletes?: A Prospective Study
Am J Sports Med 2014 42: 906
27. Christophe Charousset, M.D., Amine Zaoui, M.D., Laurence Bellaïche, M.D., and
Michel Piterman, M.D. Does Autologous Leukocyte-PlateleteRich Plasma Improve Tendon Healing in Arthroscopic Repair of Large or Massive Rotator Cuff Tears? Arthroscopy: The Journal of Arthroscopic and Related Surgery, Vol 30, No 4 (April), 2014: pp 428-435
28. Randelli P1, Arrigoni P, Ragone V, Aliprandi A, Cabitza P. Platelet rich plasma in arthroscopic rotator cuff repair: a prospective RCT study, 2-year follow-up. J Shoulder Elbow Surg. 2011 Jun;20(4):518-28
29. Shaikh AH, O’Donnell T :Platelet Rich Plasma injection as an alternative treatment for rotator cuff tendinitis of shoulder. Selected as the 2013 best Poster in the shoulder and Elbow category, AA0S 2013
30. Edwards SL, and al : Biologic and Pharmacologic Augmentation of rotator cuff repairs : J Am Acad Orhop Surg 2011 19 583-589
31. Dolkart O, Chechik O and al : A single dose of platelet rich Plasma improves the organization and strength of a repaired rotator cuff . presentation at AAOS 2015
31. Creaney L, Wallace A, Curtis M, Connell D. Growth factor-based therapies provide additional bene^t
beyond physical therapy in resistant elbow tendinopathy: a prospective, single-blind, randomized
trial of autologous blood injections versus platelet-rich plasma injections. Br J Sports Med 2011 Mar
32. Sanchez M, Anitua E : Ligamentization of tendon grafts treated with an endogenous preparation rich in grpwth factors : Gross morphology and histology. Athroscopy 2010 ; 26 (4) : 470-480
Vous en avez peut être déjà entendu parlé dans…?
Prise en charge
La Caisse d’Assurance Maladie ne rembourse que partiellement ce traitement. Un devis préalable et une facture détaillée vous seront remis. Si les injections de PRP concernaient une lésion qui a fait l’objet d’une déclaration d’accident à une assurance (activité de loisir, licence sportive), vous pourrez réclamer à cette assurance le remboursement des frais non pris en charge par l’Assurance Maladie.